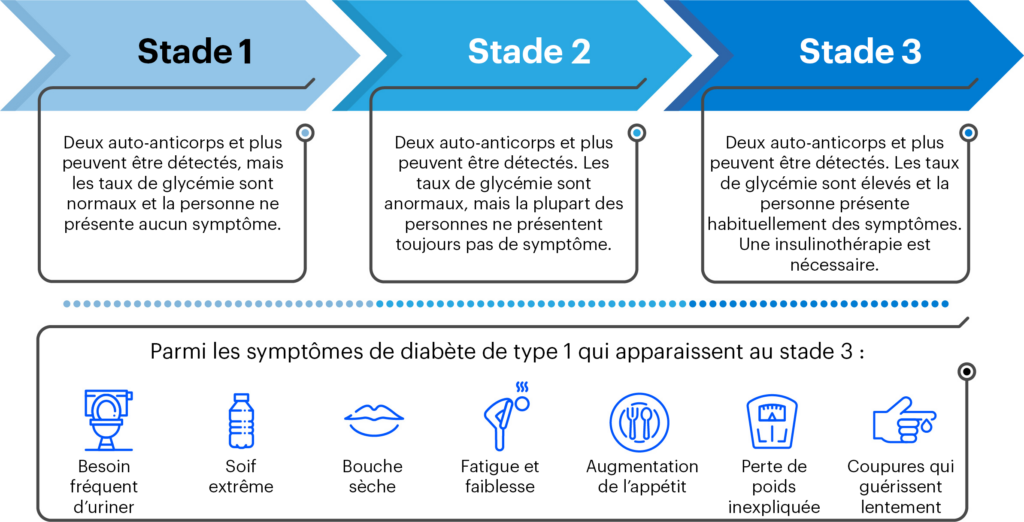
Une partie importante du financement de FRDJ Canada sert à soutenir les recherches axées sur la guérison pour le diabète de type 1 (DT1). L’une de ces voies est celle des thérapies de remplacement des cellules souches qui remplacent les cellules bêta responsables de la production d’insuline tuées par le processus auto-immun au cours du DT1. L’objectif est d’implanter de nouvelles cellules bêta qui pourront un jour recommencer à produire de l’insuline chez une personne atteinte de DT1, réduisant, voire éliminant, le besoin d’insuline administrée de l’extérieur, soit par une pompe, un stylo ou des injections quotidiennes multiples. Il existe deux sources principales de cellules productrices d’insuline : les cellules pancréatiques de donneurs décédés et les îlots de Langerhans dérivés de cellules souches humaines.
À la fin du mois de juin 2023, la Food and Drug Administration (FDA) des États-Unis a approuvé le Lantidra™ de CellTrans, la première thérapie cellulaire autorisée aux États-Unis, pour une utilisation chez les adultes incapables d’obtenir des taux de glycémie moyens en raison d’épisodes actuels et répétés d’hypoglycémie sévère.
Cette thérapie utilise les îlots de Langerhans d’un donneur décédé et les implante chez des personnes atteintes de DT1 souffrant d’hypoglycémies sévères et répétées. Cette thérapie, tout comme une greffe d’organe, nécessite l’utilisation de médicaments immunosuppresseurs.
Par ailleurs, Eli Lilly and Company a annoncé un accord pour acquérir Sigilon Therapeutics, une société biopharmaceutique publique avec laquelle elle travaillait en partenariat depuis 2018 pour développer des thérapies à base de cellules d’îlots de Langerhans encapsulées pour le DT1. Ces thérapies cellulaires incluent SIG-002, une thérapie cellulaire encapsulée qui utilise Afibromer™, un biomatériau conçu pour protéger du système immunitaire les cellules productrices d’insuline dérivées de cellules souches.
Pour Lilly, cette acquisition est l’aboutissement d’années de partenariat pour le développement de SIG-002. Rogerio Vivaldi, M.D., PDG de Sigilon, affirme que « Lilly est bien placé pour appliquer ses capacités cliniques et techniques de pointe à l’exploitation du plein potentiel de SIG-002 pour le bénéfice des patients et de leurs soignants. »
Outre le Fonds DT1 de FRDJ, Eli Lilly a également investi dans Seraxis, une jeune entreprise financée par du capital-risque qui met au point des thérapies cellulaires de remplacement des îlots de Langerhans pour le DT1.
Le Lantidra, développé par CellTrans, est dirigé par José Oberholzer, M.D. Il est titulaire d’une subvention de JDRF International et membre du Consortium de remplacement des cellules de FRDJ. FRDJ a décerné au Dr Oberholzer un financement important depuis 2006 pour ses travaux sur les thérapies de remplacement dérivées de cellules souches. JDRFI a également accordé à Daniel Anderson, Ph.D., et à Robert Langer, Sc.D., plus de 20 millions de dollars de financement depuis 2004 pour aider à soutenir le développement de l’Afibromer, le matériau utilisé dans le SIG-002.
En quoi cela peut-il aider les personnes atteintes de DT1?
Le développement de thérapies à base de cellules d’îlots de Langerhans est essentiel à la stratégie de FRDJ visant à trouver des thérapies de guérison pour le DT1, et cette nouvelle s’inscrit dans une longue tradition de soutien de FRDJ aux chercheurs universitaires à l’origine de ces thérapies.
Il s’agit d’une nouvelle excitante car elle représente la première voie commerciale approuvée pour la thérapie cellulaire qui, jusqu’à présent, n’était qu’expérimentale (c’est-à-dire par le biais d’essais cliniques). CellTrans n’a pas encore fourni de détails sur la disponibilité commerciale ou la couverture d’assurance et son utilisation n’est actuellement approuvée qu’aux États-Unis.
L’acquisition de Sigilon par Lilly est un signe d’intérêt de la part d’une des plus grandes sociétés pharmaceutiques au monde pour le développement de thérapies à base de cellules d’îlots de Langerhans—une autre société pharmaceutique de premier plan qui travaille à la recherche de thérapies de guérison pour le DT1. Cela inclut également les activités de remplacement des îlots de Langerhans dérivés de cellules souches, à la fois du partenariat de Novo Nordisk avec Aspect Biosystems et de la mise à jour positive de Vertex à l’ADA, ainsi que, du côté de l’immunologie, l’acquisition de Provention Bio par Sanofi.
L’approbation du Lantidra par la FDA et l’accord de Lilly pour l’acquisition de Sigilon représentent deux percées pour les thérapies de guérison.
FRDJ Canada poursuit actuellement de multiples approches thérapeutiques pour guérir le DT1, et le Fonds DT1 a fait 37 investissements dans des sociétés soutenues par du capital-risque ayant des programmes pour le DT1 depuis son lancement en 2016, avec plus de 20 programmes de guérison actifs en cours de développement. Grâce au Fonds DT1, FRDJ continuera de soutenir et de poursuivre ces options afin d’aider à mettre ces thérapies qui changent la vie à la disposition d’un plus grand nombre de personnes, et ce, plus rapidement.