*Illustration tirée de viacyte.com/pipeline/
L’une des priorités importantes de FRDJ consiste à financer les recherches les plus prometteuses qui pourraient mener à des thérapies curatives potentielles pour le diabète de type 1 (DT1).
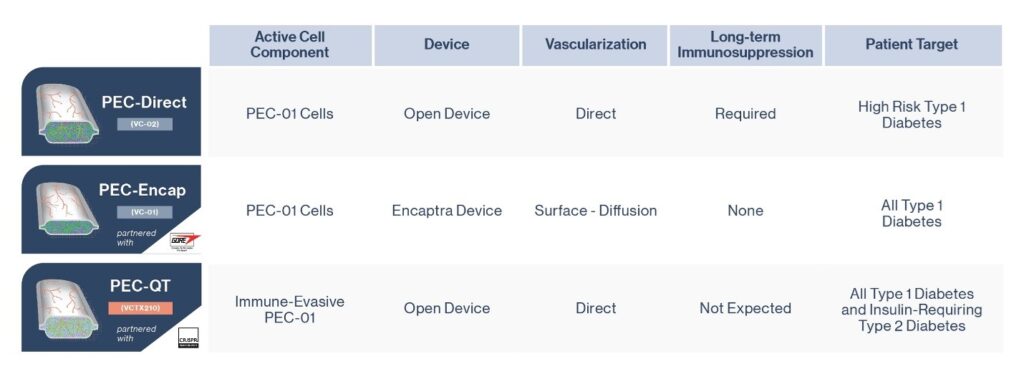
ViaCyte, une entreprise de remplacement des cellules soutenue par FRDJ depuis longtemps, dispose de trois produits distincts de thérapie de remplacement des cellules souches en cours d’élaboration, tous dans le but de réduire ou d’éliminer le besoin d’insuline externe pour les personnes atteintes de DT1.
Les chercheurs explorent des moyens d’utiliser les cellules souches comme source renouvelable de cellules productrices d’insuline, lesquelles une fois transplantées, remplaceraient les cellules bêta qui sont détruites dans le corps d’une personne atteinte de DT1, leur permettant ainsi de produire de l’insuline de nouveau. Ceci viendrait réduire ou éliminer la quantité d’insuline externe requise par une personne atteinte de DT1 (par injection, stylo injecteur ou pompe) pendant des mois et même des décennies.
Les plus grands défis de la thérapie de remplacement de cellules souches consistent à identifier la source appropriée de cellules souches (c’est-à-dire, des cellules pancréatiques ou des cellules hépatiques) et à s’assurer qu’elles fonctionnent bien et qu’elles ne seront pas rejetées par le système immunitaire du receveur. Tout comme un organe transplanté, la plupart des thérapies de remplacement de cellules souches nécessitent des médicaments immunosuppresseurs pour éviter le rejet.
Mises à jour sur les essais cliniques de ViaCyte
PEC-Encap (VC-01™ ; voir sur l’illustration, deuxième ligne) était le premier produit de ViaCyte comprenant un précurseur dérivé de cellules souches qui, une fois implanté chez l’homme, a prouvé que ces cellules mûrissent pour devenir des cellules bêta produisant de l’insuline.

La deuxième technologie de l’entreprise, PEC Direct (VC-02™ ; voir sur l’illustration, première ligne), fait maintenant l’objet de deux articles qui communiquent les résultats préliminaires de son étude clinique, à laquelle a participé une équipe internationale de cliniciens et de chercheurs, dont plusieurs de l’Université d’Alberta et de la Faculté de médecine de l’Université de Colombie-Britannique et de Vancouver Coastal Health (VCH).
L’étude de l’UCB-VCH fait partie des essais cliniques internationaux plus vastes menés par ViaCyte, qui examine également l’efficacité de la thérapie de remplacement des cellules sur des participants dans des sites au Canada, aux États-Unis et en Belgique.
L’un des nouveaux articles étudie 15 participants à l’essai sur le site de Vancouver. Au début de l’étude de l’UCB-VCH, chaque participant s’est vu implanter plusieurs dispositifs contenant des cellules ViaCyte juste sous la peau. Chaque dispositif, aussi mince qu’une carte de crédit, contenait des millions de cellules cultivées en laboratoire et provenant initialement d’une seule lignée de cellules souches. Ces cellules avaient été préparées pour devenir des cellules bêta productrices d’insuline.
Six mois après l’implantation, les cellules avaient non seulement survécu mais étaient devenues des cellules bêta productrices d’insuline, ce qui a aidé les participants à l’essai à connaître leurs taux de glycémie et à libérer de l’insuline quand cela était nécessaire.
Cette étude a utilisé les taux de peptide C (libéré dans le sang comme sous-produit de la production d’insuline) pour mesurer l’insuline produite par les cellules implantées. Les chercheurs ont trouvé que les taux de peptide C augmentaient après que les patients aient mangé un repas, preuve d’une fonction normale des cellules bêta. Ce résultat est significatif car l’insuline externe (qu’elle soit reçue par injection, pompe ou stylo injecteur) ne génère pas de peptide C.
Les participants ont également passé 13 % de temps en plus dans la fourchette cible de glycémie et certains ont pu réduire la quantité d’insuline qu’ils s’injectaient.
L’insuline produite par les cellules implantées n’était pas suffisante pour inciter les participants à renoncer complètement à l’insuline externe, mais les cellules ont survécu et maintenu leur fonction une année complète après la transplantation. Cela témoigne du potentiel de durabilité de ce type de thérapie de remplacement des cellules et peut idéalement éviter les implantations fréquentes qui doivent être effectuées par intervention chirurgicale. Fait important, l’essai n’a révélé aucun problème de sécurité.
Cette recherche a été financée par FRDJ Canada, ainsi que par le Réseau de cellules souches du Canada, Vancouver Coastal Health Research Institute, les Instituts de recherche en santé du Canada, ViaCyte Inc. et California Institute for Regenerative Medicine.
Qu’est-ce que cela signifie pour les personnes atteintes de DT1 ?
Ces études apportent de l’espoir et un optimisme prudent concernant la thérapie de remplacement des cellules comme une voie possible vers un traitement curatif du DT1.
« Nos résultats prouvent l’incroyable potentiel de ce traitement à base de cellules souches. Grâce à des recherches plus approfondies, ce traitement pourrait un jour éliminer la dépendance aux injections d’insuline et transformer la gestion du diabète de type 1. », a déclaré l’auteur principal de l’étude, le Dr Timothy Kieffer, professeur aux départements de chirurgie et de sciences cellulaires et physiologiques de la faculté de médecine de l’UCB, et récemment nommé conseiller scientifique en chef de ViaCyte.
La prochaine étape consiste pour les chercheurs à déterminer les cellules optimales pour la transplantation et le meilleur site de transplantation. Il faudra également étudier davantage la durée pendant laquelle les cellules fonctionnent efficacement, restent sûres, si un plus grand nombre de cellules est requis pour la production d’insuline à long terme et s’il est possible de se passer d’un traitement immunosuppresseur.
Un troisième produit de remplacement des cellules ViaCyte comprenant une source de cellules souches génétiquement modifiées, VCTX210, mis au point en partenariat avec CRISPR Technologies, a récemment été approuvé pour un essai clinique par Santé Canada. Contrairement au produit PEC-Direct utilisé dans les nouveaux résultats publiés, ce produit ne requière pas d’immunosuppression – une prochaine étape clé sur la feuille de route du remplacement des cellules. (Voir dernière ligne de l’illustration)
Apprenez-en plus ici : frdj.ca/des-nouvelles-excitantes-sur-les-nouveaux-essais-cliniques-approuves-par-sante-canada/
Les essais cliniques de ViaCyte sont l’un des nombreux traitements potentiels de remplacement des cellules que FRDJ appuie à l’échelle mondiale, dans le cadre de sa stratégie de recherche globale. Apprenez-en plus à ce sujet ici : frdj.ca/la-recherche/